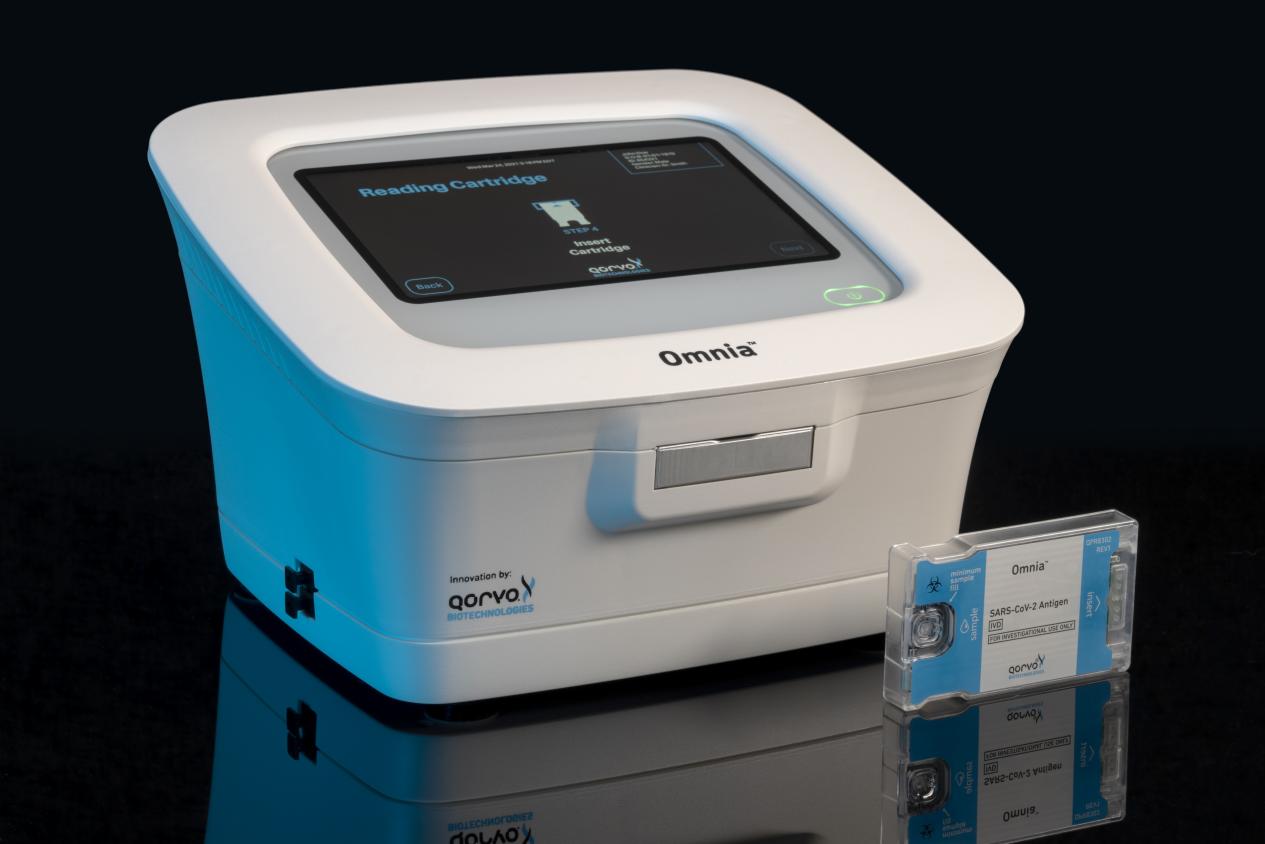
中国北京– 2022年8月10日–移动应用、基础设施与航空航天、国防应用中RF解决方案的领先供应商Qorvo®,Inc.(纳斯达克代码:QRVO)今天宣布,美国食品和药物管理局(FDA)已为Qorvo的Omnia™SARS-CoV-2 抗原检测颁发了紧急使用授权(EUA),使其可用于现场护理(POC)环境。

该检测被授权用于在症状发作后的六天内进行定性检测,确定疑似COVID-19患者鼻拭子标本中是否存在SARS-CoV-2(COVID-19) 的核衣壳病毒抗原。此外,该检测还被授权用于暂无疑似COVID-19症状或其他流行病学表现的风险人群,规则为在三天内检测两次,检测间隔时间不少于24小时且不超过48小时。此前,FDA已对该检测颁发紧急使用授权,批准将其用于实验室等中等和高度复杂环境。此次紧急使用授权将Qorvo的市场拓展至实验室之外,包括医生办公室、急诊中心、零售药店、员工健康检测,以及任何其他可进行临床实验室改进修正案(CLIA)豁免检测的场所。
Qorvo新任副总裁兼QorvoBiotechnologies 总裁ErikAllen 表示:“随着COVID-19检测趋于普遍化,并且奥密克戎变异株的病毒载量降低,现场护理环境需要高质量的快速检测基础设施。QorvoOmnia 平台提供了独到的组合形式,结合性能、自动化工作流程和可拓展性,从而高效满足现场检测需求。”
QorvoOmnia 平台采用创新诊断技术,通过高频体声波(BAW)传感器,在一个易于使用的独立平台上快速得出高度敏感和特异的COVID-19检测结果。BAW传感器技术可达到近似于分子检测能力的低检测限(LOD)水平。随着病毒载量下降,尤其是随着奥密克戎变异株及亚型株的出现,患者样本中的病毒载量较低,对现有的非处方(OTC)侧向流动检测造成了挑战。QorvoOmnia 平台则具备技术优势,能够在奥密克戎高峰期内持续准确检测COVID-19的相关抗原。
QorvoOmnia 平台在对比PCR方法的检测限(LOD)方面表现出色。Omnia平台在临床研究期间显示出85%的灵敏度(PPA),支持设备紧急使用授权,可用于现场护理;此项目由美国国立卫生研究院(NIH)拨款出资,并于2021下半年正式开展。2022年初奥密克戎变异株广泛传播期间,NIH资助开展独立研究。在该研究中,当样本达到或超过对比PCR方法的检测限时,Qorvo依然表现出色,灵敏度达到86%。所有相关研究中,特异性均达到100%。
医疗咨询公司Traeokos总裁兼首席执行官PeterMatos 表示:“如今,检测需求随着奥密克戎变异株性的产生而发生变化,Qorvo的抗原检测为客户确保了多种检测场景中所需的性能水平。”
欲知更多信息,请访问www.qorvobiotech.com。
该项目由美国卫生与公众服务部下属、美国国立卫生研究院的美国国家生物医学影像与生物工程研究所的联邦资金提供全部或部分资助,合同编号为75N92021C00008。
2021年4月,美国食品和药物管理局(FDA)为QorvoOmnia 的SARS-CoV-2抗原检测颁布了紧急使用授权(EUA),用于中等和高度复杂环境,自2022年7月起亦可用于现场护理环境。
QorvoOmnia SARS-CoV-2 抗原检测尚未获得FDA许可或批准。经FDA根据“紧急使用授权”条例授权,只能通过《1988年临床实验室改进修正案》(CLIA),42U.S.C. §263a 认证的实验室执行豁免、中等或高度复杂的测试。该项检测仅被授权用于检测来自SARS-CoV-2的蛋白质,不适用于任何其他病毒或病原体。这些测试仅授权用于声明的期间,即根据“紧急使用授权”法案第564(b)(1)节,21U.S.C. § 360bbb-3(b)(1),有理由授权紧急使用体外诊断测试来检测和/或诊断COVID-19的情况,除非该授权提前终止或撤销。